با حرکت صنعت مراقبتهای بهداشتی به سمت پزشکی شخصیسازیشده، سیستمهای دارورسانی هدفمند به طور فزایندهای پیچیده میشوند و به درمانها اجازه میدهند تا با نیازهای بهداشتی هر فرد تنظیم شوند.
دارورسانی هدفمند روشی برای رساندن دارو به یک ناحیه متمرکز از بدن است، برخلاف رساندن آن به کل بدن. این روش متکی بر دارورسانی با واسطه نانوذرات است که میتواند با استفاده از میدانهای الکتریکی و مغناطیسی، امواج صوتی (آکوستیک) و مواد مهندسی شده شیمیایی در بدن هدایت شود.
انتظار میرود این صنعت تا سال 2035 به 2,000 میلیون دلار برسد که نشاندهنده تأثیر بالقوه آن بر بخش مراقبتهای بهداشتی است.
اکنون تیمی از دانشمندان یک سیستم جدید دارورسانی هدفمند را با استفاده از "ذرات میکروسکوپی شبیه گل" یا نانوساختارهای سلسله مراتبی (HNS) که توسط امواج صوتی کنترل میشوند، به نمایش گذاشتهاند.
هدف این تیم، به رهبری دانشمندان ETH Zürich، غلبه بر برخی از محدودیتهای مشاهده شده در سیستمهای دارورسانی رانده شده معمولی با استفاده از امواج صوتی بود که از حبابهای میکروسکوپی برای رساندن دارو استفاده میکنند.
Interesting Engineering (IE) با پل ورده و پروفسور دانیل رازانسکی از ETH Zürich، نویسندگان همکار این مطالعه، صحبت کرد.
قبل از پرداختن به این مطالعه، ابتدا نیاز به دارورسانی هدفمند و گزینههای موجود برای دستیابی به آن را درک کنیم.
تکامل دارورسانی
به طور سنتی، دارو به صورت خوراکی، موضعی و از طریق استنشاق و تزریق تجویز میشود. این روشها مؤثر هستند، اما منجر به توزیع سیستمیک میشوند، به این معنی که دارو به جای یک منطقه خاص، در سراسر بدن توزیع میشود.
این امر منجر به نیاز به دوزهای بالاتر برای جبران تلفات ناشی از متابولیسم، تعاملات ناخواسته در بافت سالم و ناکارآمدی در درمان مناطق خاص مانند مغز به دلیل سد خونی-مغزی میشود.
این مشکل به ویژه در درمانهای سرطان شدید است، جایی که داروهای شیمیدرمانی به سلولهای سالم و سرطانی در سراسر بدن حمله میکنند و منجر به عوارض جانبی شناخته شده میشوند. این درمانها میتوانند از روشهای دارورسانی هدفمند بهره زیادی ببرند.
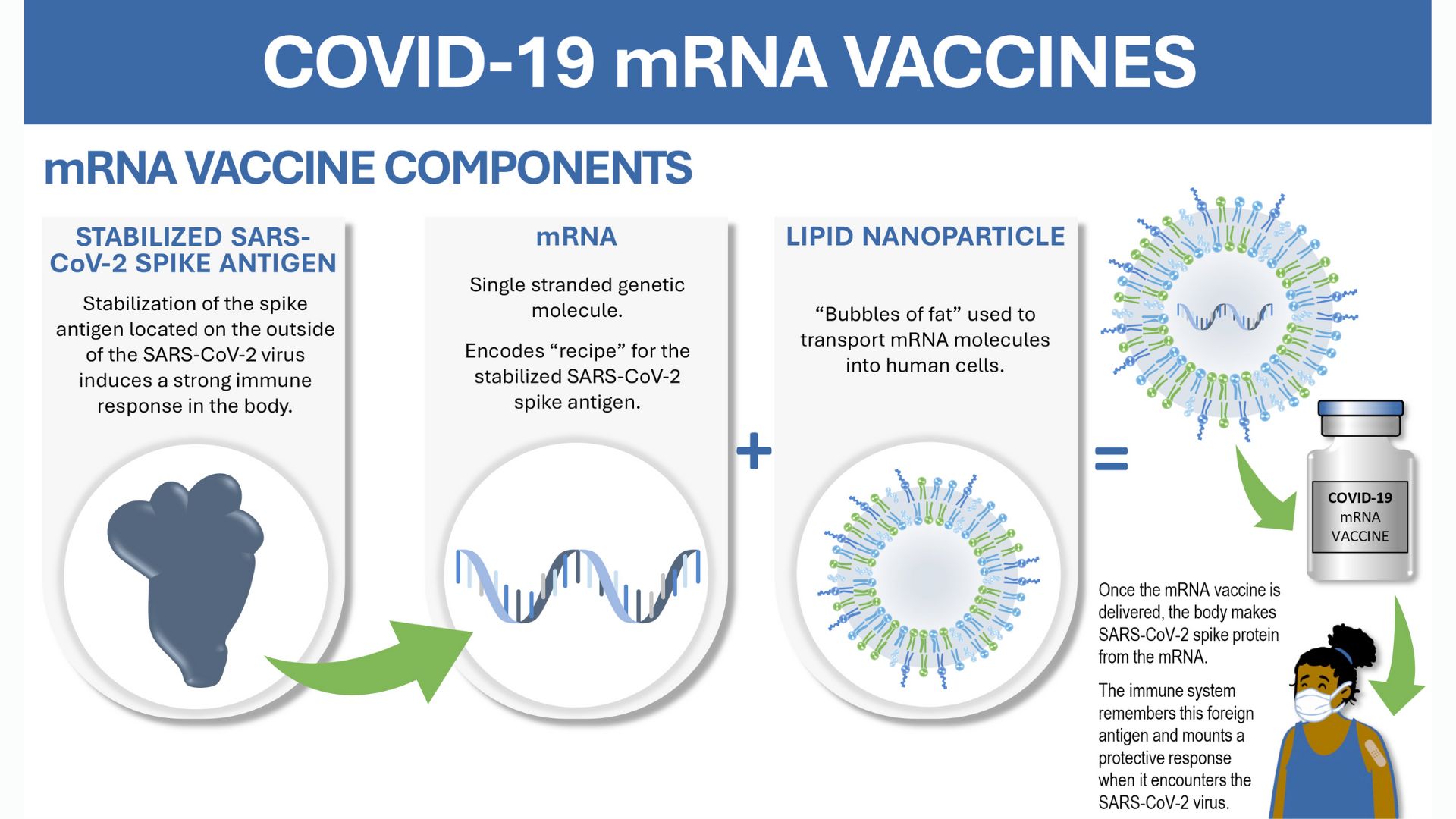
از دهه 1950، زمانی که محققان شروع به کار بر روی فناوری مدرن دارورسانی کردند، این زمینه پیشرفت زیادی داشته است. پیشرفتها از اولین داروهای خوراکی، تزریقی و کاشتنی طولانیاثر گرفته تا پیشرفت در فرمولاسیون نانوذرات لیپیدی برای واکسنهای COVID-19 را شامل میشود.
با این حال، تحقیقات در زمینه دارورسانی هدفمند هنوز نسبتاً جدید است و فقط سطح امکاناتی را که این زمینه در خود دارد، لمس میکند.
دارورسانی هدفمند
دارورسانی هدفمند با هدایت داروها به محل یا ناحیه هدف کار میکند. یک وسیله نقلیه، به شکل میکرو یا نانوحامل، برای رساندن و آزاد کردن دارو در محل مناسب استفاده میشود.
رایجترین مولکولهای مورد استفاده شامل لیپوزومها (مبتنی بر لیپید)، نانوذرات پلیمری و فلزی و حاملهای مبتنی بر پروتئین هستند.
این حاملها را میتوان به صورت فیزیکی توسط یک محرک خارجی مانور داد تا آن را به محل مورد نظر هدایت کند. رایجترین محرکهای مورد استفاده برای دستیابی به این هدف، میدانهای الکتریکی، میدانهای مغناطیسی و امواج صوتی هستند.
میدانهای الکتریکی و مغناطیسی
از میدانهای الکتریکی و مغناطیسی میتوان برای رساندن داروها به محل مورد نظر استفاده کرد. با این حال، حامل یا خود دارو باید به میدانهای الکتریکی یا مغناطیسی پاسخ دهد، یعنی باید از نظر الکتریکی باردار یا مغناطیسی باشند.
این روشها به دلیل عمق نفوذ محدود هر دو میدان از طریق بافت چالشبرانگیز هستند و نمیتوان از آنها برای مناطق عمیقتر در بدن استفاده کرد. علاوه بر این، میدانهای الکتریکی به الکترود نیاز دارند، در حالی که میدانهای مغناطیسی به آهنربا برای تولید میدانهای مربوطه نیاز دارند.
آنها همچنین در صورت عدم تمرکز کامل میدانها برای دستیابی به نتیجه مطلوب، خطر تجمع نانوذرات در مناطق نامطلوب را دارند.
امواج صوتی
داروها همچنین میتوانند با استفاده از سونوگرافی متمرکز که از نیروی تشعشع صوتی برای هل دادن داروها به سمت یک هدف استفاده میکند، تحویل داده شوند. در این سناریو، دارو در میکرو یا نانوبابلها قرار میگیرد که با استفاده از امواج صوتی هدایت میشوند.
پس از رسیدن به ناحیه هدف، حباب به صورت کنترل شده میترکد تا با تغییر فرکانس موج صوتی، دارو آزاد شود. میکرو یا نانوبابلها نفوذپذیری داروها را در مناطقی که دسترسی به آنها سخت است و حبابها میتوانند از آن عبور کنند، افزایش میدهند.
کنترل فرکانس باید بسیار دقیق باشد تا اطمینان حاصل شود که دارو در مناطق مورد نیاز تحویل داده میشود و حاملهای دارو باید به امواج صوتی پاسخگو باشند.
با توجه به ماهیت امواج صوتی که مکانیکی هستند، از استخوانها پراکنده میشوند که میتواند در تصویربرداری تداخل ایجاد کند.
هدفگیری شیمیایی و بیولوژیکی
به غیر از مکانیسمهای فیزیکی فوقالذکر، داروها همچنین میتوانند با استفاده از مولکولهای شیمیایی یا بیولوژیکی تحویل داده شوند.
هدفگیری شیمیایی با استفاده از مولکولهایی کار میکند که به شرایط شیمیایی خاص مانند سطوح آنزیم، تفاوت دما یا تغییرات pH پاسخ میدهند.
به طور مشابه، هدفگیری بیولوژیکی از مولکولهایی استفاده میکند که به نشانگرهای بیولوژیکی در بدن پاسخ میدهند، مانند آنتیبادیهایی که به پروتئینهای خاصی در سلولهای سرطانی متصل میشوند.
این روشها به محرکهای خارجی نیاز ندارند، اما به دلیل تعداد محدود مولکولهای طبیعی که با الزامات هدفگیری انتخابی مطابقت دارند، اجرای آنها دشوارتر است. این امر منجر به این میشود که محققان مجبور شوند مولکولهای جدیدی را که هدف را برآورده میکنند، مهندسی زیستی کنند.

گلهای میکروسکوپی
محققان بر روی رفع چالشهای مربوط به روشهای دارورسانی هدفمند آکوستیکی فعلی با استفاده از نانو یا میکرو حبابها تمرکز کردند.
چالش اصلی در کنترل این حبابها، پویایی مایعات بدن مانند خون است. حرکت مایع نیروهای اضافی را وارد میکند که محققان باید آنها را در نظر بگیرند تا اطمینان حاصل کنند که بر نیروهای صوتی مورد نیاز برای کنترل غلبه نمیکنند.
به دلیل این سطح از پیچیدگی، رویکردهای قبلی بر روشهای مایع ثابت متمرکز بودند و از تنظیمات پیچیده با چندین مبدل تشکیل شده بودند.
راه حل؟ جایگزینی حبابها با ساختارهای شبیه گل که محققان آن را HNS مینامند. هندسه HNS نه تنها به دارورسانی کمک میکند، بلکه به تصویربرداری نیز کمک میکند.
هندسه HNS
شکل و ساختار HNS نقش مهمی در عملکرد آن به عنوان یک سیستم دارورسانی و برای تصویربرداری ایفا میکند.
HNS از نانوصیفههای دو بعدی ساخته شده از مواد سازگار با زیست تشکیل شده است. این صیفههای دو بعدی سپس به ذرات میکروسکوپی شبیه گل مونتاژ میشوند و صیفهها به عنوان گلبرگ عمل میکنند.
ورده در توضیح انتخاب مواد به IE گفت: "اکسید روی به دلیل سازگاری زیستی ثابت و استفاده گسترده در کاربردهای زیست پزشکی به عنوان امیدوارکنندهترین نامزد ظاهر شد."
"هنگامی که ماده پایه را داشتیم، عملکرد آن را با گنجاندن عوامل کنتراست تصویربرداری پزشکی افزایش دادیم. به عنوان مثال، ذرات اکسید روی را با اتمهای گادولینیوم برای فعال کردن MRI دوپ کردیم و آنها را با طلا، پلی دوپامین و سبز ایندوسیانین برای تصویربرداری نوری و اپتواکوستیک عاملدار کردیم."
ساختار شبیه گل سطوح متعددی را برای اتصال داروها به آن ارائه میدهد. به گفته محققان، HNS دارای مساحت سطحی تا 250 برابر بیشتر از یک ذره جامد با همان اندازه است. سطوح متعدد همچنین امواج صوتی را منعکس میکنند که میتوانند توسط تکنیکهای تصویربرداری مانند سونوگرافی شناسایی شوند و امکان تجسم را فراهم میکنند.
علاوه بر این، محققان دریافتند که سطوح نوک تیز گردابهای کوچکی را در جریان خون اطراف خود ایجاد میکنند که با امواج صوتی برخورد میکنند. این گردابها میکروذرات را با هم جمع میکنند و آنها را در جای خود نگه میدارند و ردیابی آنها را در بدن آسانتر میکند.
پروفسور رازانسکی توضیح داد: "این نیروها به اندازه کافی قوی هستند که در برابر کشش ناشی از جریانهای مایع با سرعت بالا، مانند جریانهای موجود در رگهای خونی، مقابله کنند."
این یک پیشرفت قابل توجه نسبت به سیستم دارورسانی مبتنی بر حباب بود، جایی که جریان خون سریع ردیابی و کنترل ذرات را سختتر میکرد.
بهتر از قبل کار میکند!
محققان HNS خود را در سیالی با جریانی قابل مقایسه با جریان خون در رگها آزمایش کردند. آنها توانستند HNS را در سیال به دام بیندازند، یا به عبارت دیگر، کنترل و حرکت دهند. سیستمهای مبتنی بر حباب قبلی فقط در سیالات با جریان بسیار کندتر کار میکردند، که این یک پیشرفت قابل توجه است.
آنها سیستم خود را در لولهها، کانالهای میکرو سیالی و همچنین در ورید فمورال یک موش آزمایش کردند و با موفقیت چندین ذره را به دام انداختند و تصویربرداری سه بعدی در زمان واقعی را انجام دادند.
یکی دیگر از کاربردهای غیرمنتظره HNS برای تصفیه فاضلاب دیده شد. مواد سازگاری زیستی نشان دادند و هیچ سمیت خون قابل توجهی مشاهده نشد.
ورده اظهار داشت: "این ذرات پتانسیل زیادی به عنوان حاملهای دارویی قابل هدایت یا میکرورباتها نشان میدهند. سطح بسیار بالای آنها به آنها اجازه میدهد تا مقادیر زیادی مولکول را حمل کنند. علاوه بر این، انعطاف پذیری در انتخاب مواد، هم دارورسانی و هم تصویربرداری زیست پزشکی چندوجهی را ممکن میسازد."
علیرغم نمایش موفقیتآمیز HNS برای دارورسانی هدفمند، محققان هنوز از جزئیات کامل مکانیسم به دام انداختن مطمئن نیستند و جایی برای بهینهسازی در آینده باقی میگذارند.
پروفسور رازانسکی در مورد بهبودهای تنظیمات خود گفت: "در حال حاضر، ما از مواد سازگار با زیست به مواد زیست تخریب پذیر برای ذرات انتقال مییابیم. این تغییر به طور قابل توجهی ایمنی آنها را افزایش میدهد، زیرا بدن میتواند آنها را تجزیه کرده و در عرض چند روز به محصولات جانبی بیضرر از بین ببرد و خطر انسداد در رگها را کاهش دهد."
محققان همچنین قصد دارند مکانیسمهای آزادسازی در صورت تقاضا را پیادهسازی کنند.
در حالی که آزمایشهای آزمایشگاهی برای پزشکی شخصیسازیشده امیدوارکننده است، انتقال به آزمایشهای بالینی هنوز دور است. این امر مستلزم ارزیابی سمیت طولانیمدت میکروذرات و تعامل با سیستم ایمنی است. با این حال، محققان خوشبین هستند که به دلیل تنوع گسترده مواد موجود، میتوان این چالشها را مدیریت کرد.
این مطالعه در Advanced Materials منتشر شده است.