کی ساتو پنج سال پیش به دنبال چالش بزرگ بعدی خود بود که با آن - و جهان - روبرو شد. این ویروس شناس اخیراً یک گروه مستقل در دانشگاه توکیو راه اندازی کرده بود و در تلاش بود تا جایگاهی برای خود در زمینه شلوغ تحقیقات HIV ایجاد کند. او گفت: "من فکر کردم، 'برای 20 یا 30 سال آینده چه کاری می توانم انجام دهم؟'"
او پاسخی را در SARS-CoV-2، ویروس مسئول همهگیری کووید-۱۹، یافت که به سرعت در سراسر جهان در حال گسترش بود. در مارس ۲۰۲۰، زمانی که شایعاتی مبنی بر اینکه توکیو ممکن است با قرنطینه ای مواجه شود که فعالیت های تحقیقاتی را متوقف کند، ساتو و پنج دانشجو به آزمایشگاه مشاور سابق خود در کیوتو رفتند. در آنجا، آنها شروع به مطالعه پروتئین ویروسی کردند که SARS-CoV-2 برای خاموش کردن اولین پاسخ های ایمنی بدن از آن استفاده می کند. ساتو به زودی کنسرسیومی از محققان را تأسیس کرد که حداقل ۵۰ مطالعه در مورد این ویروس منتشر می کند.
تنها در پنج سال، SARS-CoV-2 به یکی از دقیق ترین ویروس های مورد بررسی در این سیاره تبدیل شد. به گفته پایگاه داده استنادی Scopus، محققان حدود ۱۵۰۰۰۰ مقاله تحقیقاتی در مورد آن منتشر کرده اند. این تقریباً سه برابر تعداد مقالات منتشر شده در مورد HIV در همان دوره است. دانشمندان همچنین تاکنون بیش از ۱۷ میلیون توالی ژنوم SARS-CoV-2 تولید کردهاند که بیشتر از هر موجود زنده دیگری است. این امر دیدگاهی بینظیر از روشهایی که ویروس با گسترش عفونتها تغییر میکند، ارائه داده است. تام پیکاک، ویروسشناس در مؤسسه پیربرایت در نزدیکی ووکینگ، بریتانیا، میگوید: «فرصتی برای دیدن یک همهگیری در زمان واقعی با وضوح بسیار بالاتر از آنچه قبلاً قابل دستیابی بود، وجود داشت.»
اکنون، با قرار گرفتن مرحله اضطراری همهگیری در آینه عقب، ویروسشناسان در حال بررسی این موضوع هستند که در چنین مدت کوتاهی چه چیزی میتوان در مورد یک ویروس آموخت، از جمله تکامل آن و تعاملات آن با میزبانهای انسانی. در اینجا چهار درس از این همهگیری وجود دارد که به گفته برخی میتواند پاسخ جهانی به همهگیریهای آینده را تقویت کند - اما تنها در صورتی که مؤسسات علمی و بهداشت عمومی برای استفاده از آنها وجود داشته باشند.
در ۱۱ ژانویه ۲۰۲۰، ادوارد هولمز، ویروسشناس در دانشگاه سیدنی، استرالیا، آنچه را که اکثر دانشمندان اولین توالی ژنوم SARS-CoV-2 میدانند، در یک تابلوی گفتگوی ویروسشناسی به اشتراک گذاشت. او این داده ها را از ژانگ یونگژن، ویروس شناس در چین دریافت کرده بود.
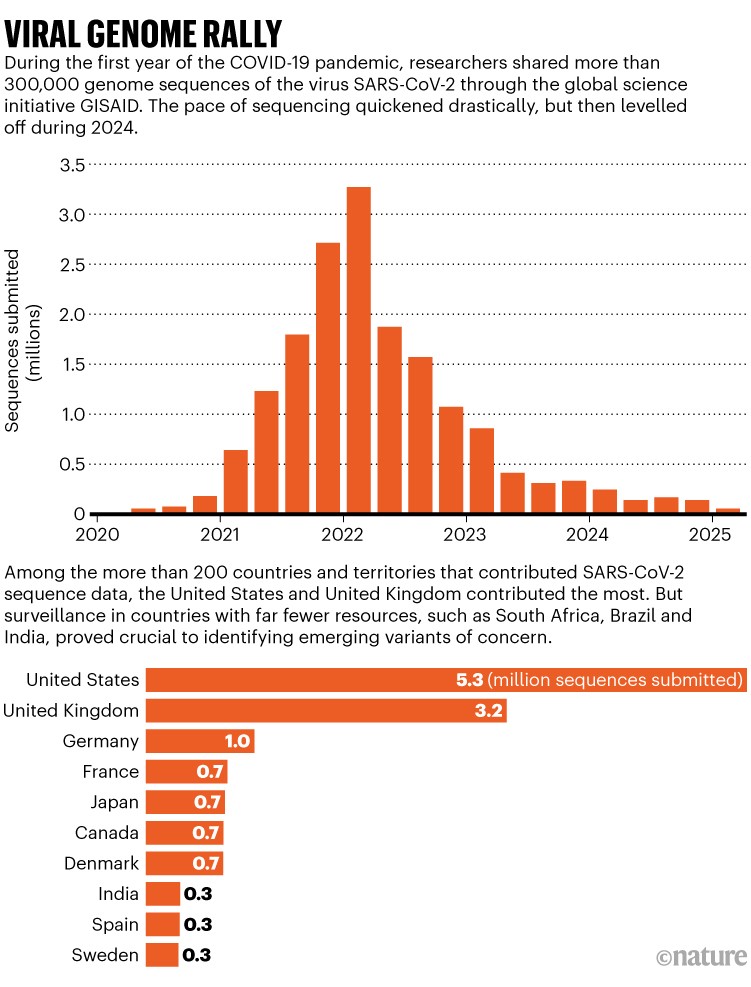
تا پایان سال، دانشمندان بیش از ۳۰۰۰۰۰ توالی را به مخزنی به نام «ابتکار جهانی به اشتراکگذاری همه دادههای آنفولانزا» (GISAID) ارسال کرده بودند. نرخ جمعآوری دادهها از آنجا فقط سریعتر شد، زیرا انواع نگرانکنندهای از ویروس ریشه دواندند. برخی از کشورها منابع عظیمی را صرف توالییابی SARS-CoV-2 کردند: بریتانیا و ایالات متحده با هم بیش از ۸.۵ میلیون سهم داشتند (به «تجمع ژنوم ویروسی» مراجعه کنید). در همین حال، دانشمندان در کشورهای دیگر، از جمله آفریقای جنوبی، هند و برزیل، نشان دادند که نظارت کارآمد می تواند انواع نگران کننده را در محیط های کم منابع شناسایی کند.
در همهگیریهای قبلی، مانند شیوع ابولا در غرب آفریقا در سالهای ۲۰۱۳–۲۰۱۶، دادههای توالییابی خیلی کند وارد میشدند تا بتوانند نحوه تغییر ویروس را با گسترش عفونتها ردیابی کنند. اما به سرعت مشخص شد که توالیهای SARS-CoV-2 با حجم و سرعت بیسابقهای وارد خواهند شد، به گفته اما هاجکرافت، متخصص اپیدمیولوژی ژنومی در مؤسسه بهداشت گرمسیری و عمومی سوئیس در بازل. او روی تلاشی به نام Nextstrain کار میکند که از دادههای ژنوم برای ردیابی ویروسها، مانند آنفولانزا، برای درک بهتر گسترش آنها استفاده میکند. هاجکرافت میگوید: «ما بسیاری از این روشها را توسعه داده بودیم که از نظر تئوری میتوانستند بسیار مفید باشند. و ناگهان، در سال ۲۰۲۰، فرصتی پیدا کردیم تا ظاهر شویم و نشان دهیم.»
در ابتدا، از دادههای توالییابی SARS-CoV-2 برای ردیابی گسترش ویروس در مرکز آن در ووهان، چین و سپس در سطح جهانی استفاده شد. این به سؤالات کلیدی اولیه پاسخ داد - مانند اینکه آیا ویروس بیشتر بین افراد پخش میشود یا از منابع حیوانی مشابه به انسان. این داده ها مسیرهای جغرافیایی که ویروس از طریق آن سفر کرده بود را نشان داد و آنها را بسیار سریعتر از تحقیقات اپیدمیولوژیک معمولی نشان داد. بعداً، انواع سریعتر انتقال ویروس شروع به ظاهر شدن کردند و آزمایشگاه های توالییابی را به حالت فوقالعاده رساندند. یک جمع جهانی از دانشمندان و ردیاب های آماتور انواع مختلف، دائماً در دادههای توالی در جستجوی تغییرات نگرانکننده ویروسی گشت و گذار میکردند.
جسی بلوم، زیستشناس تکاملی ویروسی در مرکز سرطان فرد هاچینسون در سیاتل، واشنگتن، میگوید: «امکان ردیابی تکامل این ویروس با جزئیات فوقالعاده فراهم شد تا دقیقاً ببینیم چه چیزی در حال تغییر است.» با در دست داشتن میلیونها ژنوم SARS-CoV-2، محققان اکنون میتوانند به عقب برگردند و آنها را مطالعه کنند تا محدودیتهای تکامل ویروس را درک کنند. هاجکرافت میگوید: «این چیزی است که ما هرگز قبلاً قادر به انجام آن نبودهایم.»
از آنجایی که هیچ کس قبلاً SARS-CoV-2 را مطالعه نکرده بود، دانشمندان با فرضیات خود در مورد نحوه سازگاری آن وارد شدند. بسیاری از آنها از تجربیات با ویروس RNA دیگری که باعث عفونت های تنفسی می شود، یعنی آنفولانزا، راهنمایی می شدند. هاجکرافت میگوید: «ما اطلاعات زیادی در مورد سایر ویروسهای تنفسی که میتوانند باعث همهگیری شوند، نداشتیم.»
آنفولانزا عمدتاً از طریق دستیابی به جهش هایی گسترش می یابد که به آن اجازه می دهد از ایمنی افراد فرار کند. از آنجایی که هیچ کس قبل از سال ۲۰۱۹ به SARS-CoV-2 آلوده نشده بود، بسیاری از دانشمندان انتظار نداشتند تا زمانی که فشار قابل توجهی توسط سیستم ایمنی افراد بر آن وارد شود، تغییرات ویروسی زیادی مشاهده کنند، چه از طریق عفونت یا بهتر از آن، واکسیناسیون.
ظهور انواع سریعتر انتقال و مرگبارتر SARS-CoV-2، مانند آلفا و دلتا، برخی از فرضیات اولیه را از بین برد. حتی تا اوایل سال ۲۰۲۰، SARS-CoV-2 یک تغییر اسید آمینه واحد را انتخاب کرده بود که به طور قابل توجهی گسترش آن را افزایش داد. بسیاری دیگر نیز به دنبال خواهند داشت.
هولمز میگوید: «چیزی که من اشتباه متوجه شدم و پیشبینی نکردم، این بود که چقدر از نظر فنوتیپی تغییر میکند.» «شما این شتاب شگفتانگیز را در انتقالپذیری و حدت مشاهده کردید.» این نشان میدهد که SARS-CoV-2 زمانی که در ووهان، شهری با میلیونها نفر، ظاهر شد، به طور خاص برای گسترش بین افراد سازگار نشده بود. او اضافه میکند که این ویروس به خوبی میتوانست در یک محیط کم جمعیتتر از بین برود.
هولمز همچنین تعجب می کند که آیا سرعت سرسام آور تغییر مشاهده شده صرفاً محصول این بوده است که SARS-CoV-2 چقدر از نزدیک ردیابی شده است. آیا اگر آنها ظهور یک سویه آنفولانزا را که برای جمعیت جدید بود، با همان وضوح تماشا می کردند، همان نرخ را مشاهده می کردند؟ این هنوز باید مشخص شود.
جهش های بزرگ اولیه ای که SARS-CoV-2 برداشت، با یک لطف همراه بود: آنها به طور چشمگیری بر ایمنی محافظتی ناشی از واکسن ها و عفونت های قبلی تأثیر نگذاشتند. اما این با ظهور نوع Omicron در اواخر سال ۲۰۲۱ تغییر کرد، که مملو از تغییراتی در پروتئین "سنبله" خود بود که به آن کمک می کرد از پاسخ های آنتی بادی فرار کند (پروتئین سنبله به ویروس اجازه می دهد تا وارد سلول های میزبان شود). دانشمندانی مانند بلوم از اینکه این تغییرات چقدر سریع در انواع پس از Omicron ظاهر شدند، شگفت زده شده اند.
راویندرا گوپتا، ویروسشناس در دانشگاه کمبریج، بریتانیا، میگوید: «و این حتی شگفتانگیزترین جنبه Omicron نبود. اندکی پس از ظهور این نوع، تیم او و دیگران متوجه شدند که برخلاف انواع SARS-CoV-2 قبلی مانند دلتا که سلولهای مجاری هوایی تحتانی ریه را ترجیح میدادند، Omicron ترجیح میدهد مجاری هوایی فوقانی را آلوده کند. گوپتا میگوید: «مستندسازی اینکه یک ویروس در طول همهگیری رفتار بیولوژیکی خود را تغییر داده است، بیسابقه بود.»
ترجیح Omicron برای مجاری هوایی فوقانی احتمالاً به خفیف بودن بالینی آن - حدت نسبتاً کم آن - در مقایسه با تکرارهای قبلی کمک کرده است. اما جدا کردن این تغییر از این واقعیت که Omicron پس از آنکه بیشتر جهان شروع به ایجاد مصونیت کرد، دشوار است، و شواهدی وجود دارد که نشان میدهد Omicron به اندازه نسخه SARS-CoV-2 که در ووهان ظاهر شد، بد بود.
و اگرچه Omicron و شاخههای آن خفیفتر از آلفا، بتا و دلتا بودند، اما همه آنها ثابت کرده بودند که از تبار خود حدت بیشتری دارند و این ایده را سرنگون میکنند که ویروس تکامل مییابد تا کمتر کشنده شود. بلوم میگوید: «این ایده که نوعی قانون طبیعت وجود دارد که میگوید یک ویروس وقتی وارد میزبان جدیدی میشود به سرعت حدت خود را از دست میدهد، نادرست است.» این ایدهای است که به هر حال هرگز خریدار زیادی در بین ویروسشناسان نداشته است.
یکی از بزرگترین ترس های ساتو این است که یک نوع SARS-CoV-2 به طور چشمگیری متفاوت ظاهر شود و بر ایمنی که مانع از بیماری شدید بیشتر افراد می شود، غلبه کند. او نگران است که نتیجه فاجعه بار باشد.
قبل از اینکه گوپتا توجه خود را به SARS-CoV-2 معطوف کند، تمرکز او HIV بود، که معمولاً یک عفونت مادام العمر است. او به عنوان یک پزشک، دومین فردی را که تا به حال از طریق پیوند سلول های بنیادی خون از HIV درمان شده بود، درمان کرده بود. اما گروه تحقیقاتی او نحوه تکامل مقاومت دارویی ضد رتروویروسی را در طول ماهها و سالها در افراد مورد مطالعه قرار داد.
بیشتر دانشمندان تصور می کردند که برخلاف HIV یا سایر عفونت های طولانی مدت، ویروس های تنفسی مانند SARS-CoV-2 حاد هستند و کسانی که از عفونت های خود جان سالم به در می برند، ویروس را در عرض چند روز پاک می کنند. عفونت های طولانی مدت در آنفولانزا رخ می دهد، اما به نظر می رسد که یک بن بست تکاملی هستند. ویروس سازگار می شود تا در میزبان زنده بماند، نه اینکه به دیگران سرایت کند.

اما در اواخر سال ۲۰۲۰، گوپتا یک عفونت ۱۰۲ روزه SARS-CoV-2 را در یک مرد ۷۰ ساله با سیستم ایمنی ضعیف مشخص کرد. این عفونت در نهایت کشنده بود. در بدن این مرد، ویروس تعداد زیادی تغییرات در پروتئین سنبله ایجاد کرد. بسیاری از این تغییرات در انواع نگران کننده نیز مشاهده می شود، از جمله نوع آلفا که تعداد موارد را به شدت افزایش داد و موج دیگری از قرنطینه ها را در اواخر سال ۲۰۲۰ و اوایل سال ۲۰۲۱ برانگیخت.
مورد این مرد منجر به هیچ نوع گسترده ای نشد، اما به گوپتا، با پیشینه تکامل HIV خود، این ایده را داد که عفونت های مزمن می توانند منبع جهش های تکاملی شدید باشند که انواع نگران کننده SARS-CoV-2 را مشخص می کنند. او میگوید: «ما تصورات نادرستی را که زمینه آنفولانزا از کاری که ویروسهای تنفسی انجام میدهند، نداشتیم.»
الکس سیگال، ویروسشناس در مؤسسه تحقیقات بهداشتی آفریقا در دوربان، آفریقای جنوبی، ایده مشابهی داشت زمانی که نوع دیگری به نام بتا در کشورش شناسایی شد. آفریقای جنوبی نرخ بالایی از عفونت HIV دارد - که بسیاری از آنها درمان نشده اند - و سیگال تعجب کرد که آیا این بیش از یک تصادف است که به نظر می رسد بتا در جایی ظاهر شده است که تعداد زیادی از افراد دارای نقص ایمنی وجود دارند.
